Autoimmunerkrankungen
Autoimmunerkrankungen (Wie z.B. Lupus erythematodes, Sklerodermie, rheumatoide Arthritis, Dermatomyositis u.a.)
Definition: Autoimmunität: Störung der Immunfunktion, die zur Bildung von Antikörpern oder sensibilisierten Zellen gegen das eigene Gewebe führt.
Bei Autoimmunerkrankungen unterscheidet man zwischen:
Organspezifische Autoimmunerkrankungen
(z.B. Hashimoto-Thyreoditis, perniziöser Anämie)
mit Antikörpern gegen spezifische Organsysteme wie Schilddrüse oder Magenschleimhaut
Systemische (nicht organspezifische) Autoimmunerkrankungen
(z.B. Lupus erythematodes, Sklerodermie, rheumatoide Arthritis)
Sowohl Bindegewebsläsionen als auch Autoantikörper sind nicht auf ein Organ beschränkt.
Es gibt ein großes Spektrum von Autoantikörpern, die in verschiedenen Autoimmun-erkrankungen entdeckt wurden.
Da viele Autoimmun-Patienten mehr als ein „Zielorgan“ aufweisen, ist auch eine Überlappung verschiedener Autoantikörper möglich (beispielsweise werden bei einem Patienten mit SLE und rheumatoide Arthritis sowohl antinukleare Antikörper als auch Rheumafaktoren im Serum gefunden). Es handelt sich hier jedoch nicht um Kreuzreaktionen.
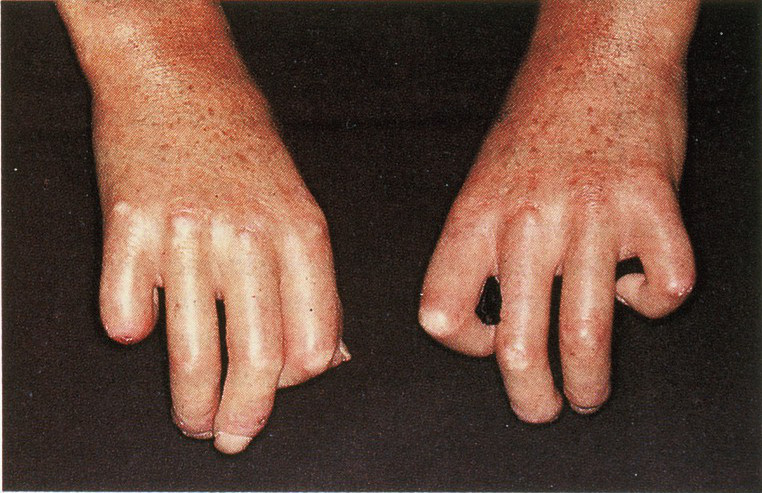
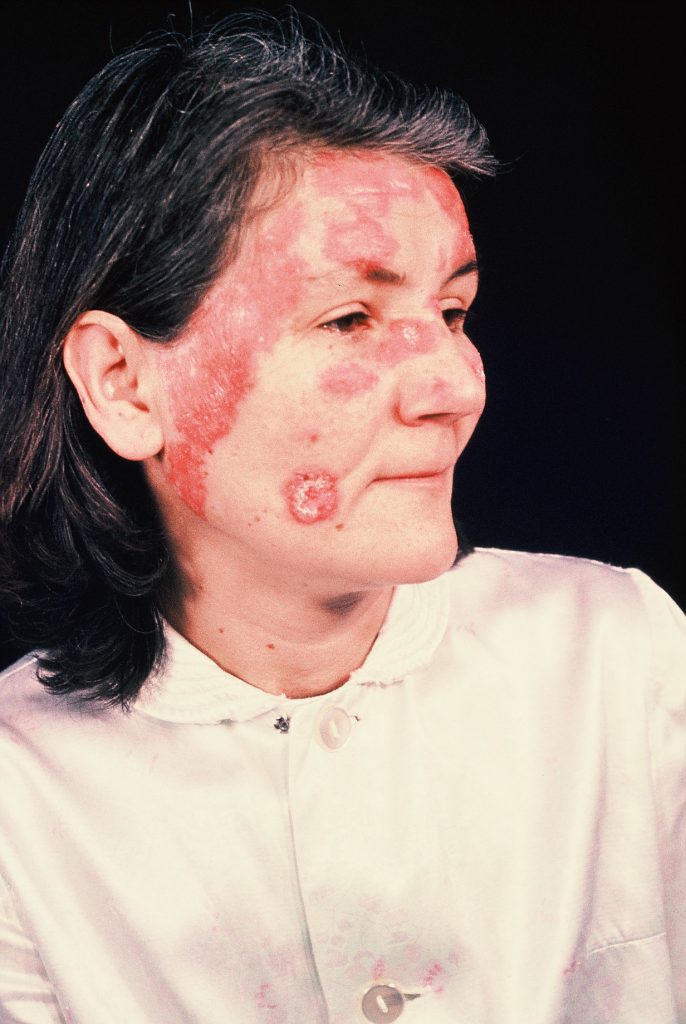
Provokationsfaktoren bei Autoimmunerkrankungen
Dr. John G. Ionescu wiss. Leiter der Spezialklinik Neukirchen
Autoimmunerkrankungen weisen in der Regel auf eine multifaktorielle Ursache hin. Hierzu gehören:
1. Genetische Faktoren:
– Bei Kindern von Hashimoto-Patienten zeigen sich hohe Werte von Schilddrüsen-Antikörper. Gleiches ist beschrieben bei Familien mit perniziöser Anämie und anderen Autoimmunerkrankungen wie z.B. primärer Zirrhose der Gallenwege
– Es besteht ein starker Zusammenhang zwischen Autoimmunerkrankungen und genetischen HLA / MHC-Markern, die zu Insulin-abhängigem Diabetes mellitus, herpetiformer Dermatitis, rheumatoide Arthritis und Versteifung der Wirbelsäule führen
2. Hormonelle Einflüsse:
– Aufgrund der hormonellen Lage treten bei Frauen weitaus häufiger Autoimmunerkrankungen auf als bei Männern.
– Bei Mäusen mit systemischen Lupus erythematodes wurden höhere Östrogenwerte gefunden, die Gabe von männlichen Hormonen reduzierte den Schweregrad der Erkrankung
– Während der Schwangerschaft verbessert sich der Schweregrad der Krankheit, besonders bei rheumatoide Arthritis, nach der Geburt gibt es oft einen schweren Rückfall.
3. Umwelteinflüsse:
Gerade bei nicht organspezifischen Autoimmunerkrankungen wie z.B. systemischer bzw. diskoider Lupus erythematodes, Sklerodermie oder Dermatomyositis besteht weniger ein genetischer Zusammenhang als vielmehr ein Einfluss der Umweltfaktoren, die zu Autoimmunprozessen führen.
– Mikrobielle Faktoren (Bakterien, Viren, Pilze):
können Autoantikörper verursachen, die eine Kreuzreaktion mit menschlichen Gewebeantigenen zeigen (molekulare Mimikry). So kann beispielsweise erst Jahre nach der Infektion mit Bakterien die Reaktion der T-Zellen auf die betroffenen Gelenke, den Herzmuskel, die Nieren, etc. erfolgen.
– Bildung einer neuen Haptenträger-Einheit:
Die Adsorption eines fremden Haptens (z.B. Penizillamin, Isoniazid, -Methyl Dopa, Quinidine, Sulfathiazol und andere Medikamente) auf ein Peptid- oder Proteinmolekül im Körper führt zur Bildung einer Haptenträger-Einheit. Gegen diese Einheit werden Antikörper gebildet, die mit dem Medikament auf der Plättchenmembran reagieren. Das Komplementsystem wird aktiviert und führt zu einer Auflösung der Plättchen, wie z.B. bei idiopathischer Purpura thrombopenica (punktförmige Blutungen).
– Metall-induzierte Autoimmunität:
Die Antigen-präsentierenden Zellen (APC) zeigen normalerweise Eigenpeptide, die mit MHC II-Molekülen einen Komplex bilden und eine T-Zellen-Toleranz erzeugen. Wenn nun Metalle an Eigenproteine gebunden sind, werden diese in den APC’s verarbeitet und induzieren veränderte, ungewöhnliche Peptide. Diese sog. „kryptischen Peptide“ oder „Neoantigene“ erzeugen nun in Verbindung mit den MHC-II neue Membranstrukturen, die zu einer Sensibilisierung der metallspezifischen T-Lymphozyten führen (siehe Bild nach W.P. Bieger, 1997)
Wenn Metalle direkt an MHC II Moleküle gebunden werden, ändern diese ihre ursprüngliche Konfiguration und verursachen die Aktivierung von autoreaktiven T-Zellen gegen die durch die Metalle geänderten Strukturen.
In Tierversuchen mit Mäusen verursachen Metalle wie Gold, Nickel, Quecksilber, Chrom und Silber eine immune Glomerulonephritis durch starke B-Zellen-Aktivierung und Synthese der spezifischen Antikörper gegen basale Membranproteine (Laminin).
Auch bei verschiedenen Krankheiten wie Sklerodermie, systemischer Lupus erythematodes, Sjögren-Syndrom, Multipler Sklerose, etc. wurde über den Zusammenhang mit metallverursachten Autoimmunprozessen berichtet (siehe Tabelle).
Patienten mit positivem Lymphozyten-Transformationstest (LTT) gegen Metalle zeigen häufig eine erhöhte Konzentration von Zirkulierenden Immunkomplexen (ZIK), antinukleare Antikörper und antineuronale Strukturen-Antikörper, die immer wieder bei Autoimmunerkrankungen nachweisbar sind (siehe Grafik nach W.P. Bieger, 1997)
4. Reduzierung der Suppressorzellen
Wenn T-Suppressorzellen (CD8+) scheitern, B-Zell-Klone zu erzeugen, die mit idiopathischer Spezifität für Eigenantigene erscheinen, entstehen Autoantikörper. In Tierversuchen unterdrückt ein Anti-CD4-Serum die Bildung von Autoantikörpern. Der Wechsel der Th1- zur Th2-Zellaktivierung während eines Antigen-Reizes kann die Autoantikörpersynthese ebenfalls begünstigen.
5. Polyklonale Aktivierung von B- und T-Zellen
Bakterielle Endotoxine können agieren, indem sie ein unspezifisches Signal zur B-Zellen-Stimulation geben und damit den Bedarf an Hilfe spezifischer T-Zellen umgehen. Auf diese Art führt die EBV-Aktivierung der B-Zellen zu einer Vielfalt von Autoantikörpern dieser Patienten (Mononukleose).
6. Gestörte Regulationsmechanismen
– Ein Ungleichgewicht der Cytokine kann Autoimmunität verursachen.
– Wenn die T-Suppressor-Aktivität durch Cyclophosphamide gestört ist, ist die Autoimmunität schwerwiegender.
– Fehler in den Regulationszellen bei rheumatoide Arthritis, systemischem Lupus erythematodes oder insulinabhängigem Diabetes mellitus (geringe T-Suppressor-funktion, gesteigerte Ig-Sekretion, unterdrückte Produktion von Thymulin und IL2, etc.)
– Neonatale Thymektomie in der Maus führt zu einer ausgedehnten organspezifischen Autoimmunerkrankung (Mangel an T-Suppressorzellen)
– Der mit der Thymus-Rückbildung verbundene Alterungsprozess beeinflusst die autoimmune Reaktivität
Integrative Therapierichtlinien der Spezialklinik Neukirchen bei Autoimmunerkrankungen wie Lupus erythematodes, Sklerodermie, Dermatomyositis etc.
1. Verminderung der Schadstoffbelastung (Total Environmental Load): Reduzierung toxischer Einflüsse von Umweltschadstoffen zu Hause oder am Arbeitsplatz
2. Konsum von organischen Nahrungsmitteln und reinem Wasser
3. Wiederherstellung einer gesunden Darmflora und normalen Darmdurchlässigkeit
4. Steigerung der Fibrinolyse und der ZIK-Eliminierung
5. Steigerung der Gewebedurchblutung mit vasoaktiven Therapien
6. Reduktion der Bildung Freier Radikale mit geeigneten Antioxidantien
7. Entgiftung des Körpers mit biologischen und pflanzlichen Mitteln
8. Regulierung des Hormonhaushaltes
9. Wiederherstellung eines normalen Schlafrhythmus
10. Reduzierung des beruflichen und privaten Stress
Fachliteratur zum Thema:
1. The Autoimmune Diseases, 3rd edition. Rose N., Mackay I. Published by Academic Press, 1998.
2. Mason B., Powrie F.: Control of immune pathology by regulatory T-cells. Curr Opin Immunol, 10 (6): 649-655, 1998.
3. Moalem G., Leibowitz-Amit R. et al: Autoimmune T-cells protect neurons from secondary degeneration after central nervous system axotomy. Nat Med. 5(1), 49-55, 1999.
4. Humphreys-Beher M.G., Brayer J. et al: An alternative perspective on the immune response in autoimmune exocrinopathy: induction of functional quiescence rather than destructive autoaggression. Scand J Immunol 49(1), 7-10, 1999.
5. Tlaskalov’a-Hogenov’a et al: Autoimmunity, immunodeficiency and mucosal infections. Chronic intestinal inflammation as a sensitive indicator of immunoregulatory defects in response to normal luminal microflora. Folia Microbiol (Praha), 43(5), 545-550, 1998.
6. DiRosa F, Barnaba V: Persisting viruses and chronic inflammation: understanding their relation to autoimmunity. Immunol Rev, 164: 17-27, 1998.
7. Ionescu G.: Biologische Merkmale in der Pathogenese des chronischen Lupus Erythematodes Discoides. Dissertation, Universität des Saarlandes, Saarbrücken, 1983.
8. Roitt E.: Essential Immunology. Blackwell Science Publishers, Oxford, 1997.
9. Ionescu J. G., Weber D., Bradford R.: Applications of redox and free radical assessment in the clinical practice. Int. J. of Gerontology, 3: 47-56, 2000.
10. Ionescu J.G., Weber D., Bradford R.: Clinical Application of Free Radical Assessment in Blood and Serum Samples by Enhanced Chemiluminescence. II. Antioxidative activity and therapy approaches with drugs and natural compounds. J. Biomed. Lab. Sci, 12, 46-56, 2000.
11. Albani S., Keystone E.C., Nelson J.L. et al: Positive selection in autoimmunity: abnormal immune responses to bacterial dnaJ antigenic determinant in patients with early rheumatoid arthritis. Nature Medicine 1, 448-452, 1995.
12. Brostoff J., Scadding G.K, Male D., Roitt I.M.: Clinical Immunology, Gower Medical Publishing, London, 1991.
13. Celis E.: T-helper cells and autoantibodies in autoimmune disease. The Immunologist 1, 126-130, 1993.
14. Weiner H.L, Meyer L.F.: Oral tolerance mechanisms and applications. Annals of the New York Academy of Science, 778, 1-453, 1996.
15. Wicker L., Wekerle H. (eds.): Autoimmunity. Current Opinion in Immunology 6, 783-852, 1995.
16. Dent A.S.: Autoimmunity, a brief overview of current theory. Townsend Letters, 193/194, 60-62, 1999.
17. Braun-Falco O., Plewig G., Wolff H.H.: Dermatology. Springer Verlag Berlin-Heidelberg-New York, 553-573, 1991.
18. Ionescu G.: Schwermetallbelastung durch Dentallegierungen. Ausleitungsverfahren bei Neurodermitis und Psoriasispatienten. Zeitung für Umweltmedizin, 3, 163-171, 1997.
19. Griem P., Gleichmann E.: Metal ion induced autoimmunity. Curr Opin Imunol, 7, 831-838, 1995.
20. Huttmann P.: Dose-response studies in murine mercury-induced autoimmunity and immun-complex disease. Toxicol Appl Pharmacol 113 (2), 199-208, 1992.
Für weitere Auskünfte betr. die individuellen Diagnose- und Therapieaspekte bei Autoimmunerkrankungen setzen Sie sich bitte mit unserer wissenschaftlichen Abteilung in Verbindung.